LABORATORIO
Legge di Boyle-MariotteAttendere caricamento appletLuciano Troilo, Creato con GeoGebra |
MISURE
Si genererà un nuovo contenitore con una diversa capienza ogni volta che si ricarica la pagina
Misurare la pressione per ogni nuovo valore del volume.
Produrre un grafico pressione in funzione del volume
Produrre un grafico pressione in funzione di 1/volume
Vedi un esempio

Verifica della legge di Boyle e Mariotte nel laboratorio scolastico

... ma si può anche fare in cucina (www.fmboschetto.it)
TEORIA
La legge di Boyle e Mariotte afferma che in condizioni di temperatura
costante la pressione di un gas perfetto è inversamente proporzionale al suo
volume, ovvero che il prodotto della pressione del gas per il volume da esso
occupato è costante: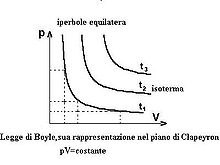

Tale costante è funzione della temperatura assoluta, della natura del
gas e del numero di moli.
La legge può essere scritta anche con la seguente notazione più completa:
![[p \cdot V]_T= K(T)](immagini/943ec42c9b5eedd8f7e6d62a15cdee1d.png)
nella quale viene indicato che la costante varia con la temperatura e che la
legge vale a temperatura costante.
La legge di Boyle e Mariotte è sperimentalmente verificata per gas che
si comportano come un gas ideale, oppure per gas in condizioni di pressione
non troppo elevate (gas rarefatto) e temperature non troppo prossime alla
temperatura di liquefazione.
Rappresentazione grafica di queste condizioni è la campana di Andrews.
STORIA
La legge di Boyle-Mariotte fu enunciata per la prima volta da Robert
Boyle (1627-1691) che nel 1662 pubblicò "A Defence of the Doctrine
Touching the Spring And Weight of the Air". Questa legge venne
riformulata in modo più preciso da Edme Mariotte (1620-1684) nel 1676,
che confermando i dati di Boyle specificò che la legge vale soltanto se
la temperatura del gas è costante.
Al gas, che spontaneamente tende ad espandersi, viene applicata una
forza peso che lo mantiene compresso.
Il grafico qui sotto riporta i dati dell'esperimento originale di
Boyle; sull'asse delle x è riportato il volume espresso nelle unità
del tempo in pollici cubi, mentre l'asse delle y riporta l'altezza della
colonna di mercurio in pollici, che per la legge di Stevin è
proporzionale alla pressione a cui è sottoposto il gas. In questi dati
il prodotto della pressione per il volume è effettivamente costante con
un errore relativo dell'1,4%.
ESERCIZI
La legge di Boyle e Mariotte può essere espressa come:
dove V1 e V2 rappresentano i valori del volume che assume il gas in una trasformazione isoterma durante la quale la pressione passa dal valore p1 al valore p2. I pedici "1" e "2" indicano quindi lo stato termodinamico del gas prima della trasformazione e a trasformazione avvenuta, essendo T1=T2.
La legge di Boyle e Mariotte può essere quindi sfruttata nel caso di trasformazioni isoterme per ricavare:
il volume del gas a trasformazione avvenuta, applicando la formula: |
 |
la pressione del gas a trasformazione avvenuta, applicando la formula: |
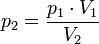 |
il volume del gas prima della trasformazione, applicando la formula: |
 |
la pressione del gas prima della trasformazione, applicando la formula: |
 |


